支气管哮喘的临床管理研究进展
2019/12/03
吉宁飞 殷凯生 黄茂
江苏省人民医院(南京医科大学第一附属医院)呼吸与危重症医学科 210029
江苏省人民医院(南京医科大学第一附属医院)呼吸与危重症医学科 210029
随着“哮喘全球创议”(GINA)的普及,大多数支气管哮喘(简称哮喘)患者都得到有效的治疗,主要治疗措施是根据患者的症状,采用以吸人糖皮质激素(ICS)为主的阶梯式抗炎治疗方案,但仍有约30%的患者对ICS应答较差,而5%~10%的重症哮喘患者所花费的费用,约占全部哮喘治疗费用的50%[1]。肺功能检查(如支气管舒张试验、支气管激发试验)是哮喘的主要诊断依据,但肺功能结果并不能提示潜在的病理类型。哮喘的临床管理要求提供个体化治疗,而哮喘的个体化治疗则需要更加精确的诊断方法以及能够提供药理学治疗反应的有效预测依据,并最终形成个体化特异性的靶向治疗方案。
1.哮喘的表型和内型
哮喘的异质性更多的体现在重症哮喘上。重症哮喘患者中,仅有少数表现为传统的过敏性哮喘症状,其余大多数呈现多样的临床以及病理学特征。基于病理生理学特征,将哮喘患者分成不同的临床亚型将会对临床有益,比如评估治疗反应和疾病进展。许多重症哮喘患者的特征是出现频繁和/或严重的急性加重,需要高剂量的糖皮质激素(激素)治疗,同时存在较差的肺功能。另外一些可变的特征,还包括特应性和过敏症、支气管舒张剂应答的程度、肥胖以及气道炎症的程度和性质等。为了改善患者的疗效,应将上述临床特征用于鉴别哮喘的特异性表型。
近来研究鉴别出4个重症哮喘亚型,包括:①早发的过敏性哮喘伴较多的遗传组分;②激素抵抗型重症中性粒细胞性哮喘;③晚发的嗜酸粒细胞性哮喘;④晚发的肥胖哮喘患者。然而上述临床特征。并不能完全体现反映出其亚型的潜在病理机制[2-3]。近来GINA将哮喘分为过敏性哮喘、非过敏性哮喘、晚发性哮喘、哮喘伴固定性气流受限以及哮喘伴肥胖等5个表型[4]。
因此需要疾病的病理生理学与患者的临床特征相连接,即内型,也就是疾病的亚型由不同的临床特征和病理学机制共同确定[5]。为了得到确定的和符合临床需要的内型,患者的临床和病理生理学特征需要结合特异性的生物学标记以及遗传信息。有研究发现,根据肺泡灌洗液中的炎症细胞不同,儿童重症哮喘可分为中性粒细胞性(37.5%)、嗜酸粒细胞性(28.1%)、混合细胞性(21.9%)和寡粒细胞性(11.1%)4个内型[6]。比利时的重症哮喘登记(BSAR)研究发现,成人重症哮喘也可分为中性粒细胞性、嗜酸粒细胞性、混合细胞性和寡粒细胞性4个内型,其比例分别为21%、55%、6%和18%[7]。不同的表型和内型,选择的治疗方案不一样,如嗜酸粒细胞性炎症,可采取激素和抗IgE等治疗,而中性粒细胞性炎症的激素疗效差,可开发针对其细胞通路的靶向治疗。
2.哮喘的病理学
2.1哮喘的气道炎症 激素治疗重症哮喘的理论基础仍然是假设哮喘就是气道炎症。目前治疗哮喘的主要药物,均基于阻断Th2优势型炎症。激素也可对超过2/3的哮喘急性加重有益[8]。除了大多为嗜酸粒细胞性炎症外,少数哮喘患者的气道是中性粒细胞性炎症占优势。临床并不能通过肺功能测定来区分中性粒细胞性哮喘与嗜酸粒细胞性哮喘,但临床可将激素治疗相对无应答视为重要的预示,作为预测中性粒细胞性哮喘的依据[9]。
2.2哮喘气道的非炎症性改变 虽然众多研究提示哮喘是Th2优势型炎症,但哮喘气道的许多结构改变均可致使哮喘进展和加重。比如,重症哮喘患者中存在黏液细胞过度增生,导致痰液大量生成并阻塞气道,上皮下基底膜增厚,其中出现细胞外基质改变(包括腱糖蛋白C);平滑肌细胞肥厚和增生,并导致平滑肌增厚;气道结缔组织沉积所致气道纤维化,出现成纤维细胞和成肌纤维细胞增生。哮喘时,气道炎症发生领先于气道重塑,或者两者平行,目前仍有争议;最近研究倾向予后者,也就是疾病早期即存在气道重塑[10]。流行病学证据也证实,激素并不能预防气道重塑的进展[11]。
气道炎症和气道结构改变的多样性,导致不同个体的哮喘患者出现各异的临床特征。因此,只采取激素的单药治疗方案,将不会对所有哮喘患者有效。真正有效的哮喘治疗方案,需要同时对气道炎症和气道重塑有效。
3.哮喘靶向治疗药物
目前GINA的阶梯化治疗方案,并不涉及个体化治疗。新的药物以及新开发的药物,均寄希望于特异性的治疗并且没有糖皮质激素的不良反应。与完全的鼠源类(-omab)单克隆抗体(单抗)比较,嵌合(-ximab)、人源化(-zumab)或者人源(-umab)的单抗更加适合人体,并且有更长的半衰期。目前研制的针对哮喘的单抗包括抗IgE、IL- 4/IL-13、IL-5、IL-9、TNF-α和胸腺基质淋巴细胞生成素(TSLP)等[12-17]。目前已进入Ⅱ期临床试验以上的哮喘靶向药物,见表1。
目前正在研制中的新颖的哮喘治疗靶向药物较多,但大多数疗效仅局限于少数哮喘患者,但研究发现,除了靶向Th2有效外,在其他T细胞亚群中均无效[18]。正由于哮喘是一种异质性疾病,特异性的治疗并不能覆盖所有非选择的哮喘人群。因此需要合理选择治疗人群,应用遗传药理学和生物学标记来鉴别哮喘表型以及预测疗效。
表1 目前治疗哮喘的靶向药物概要
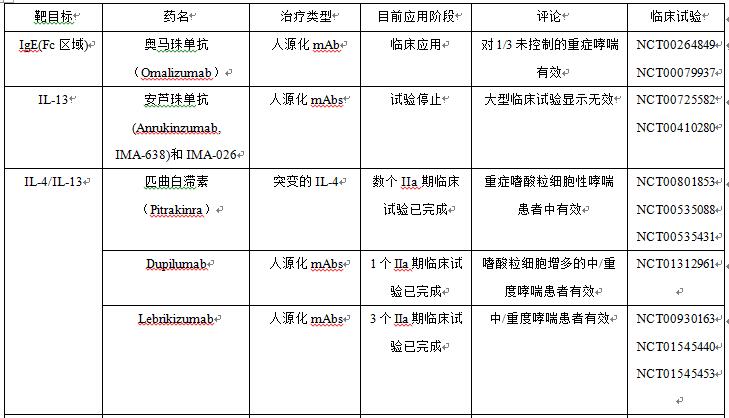
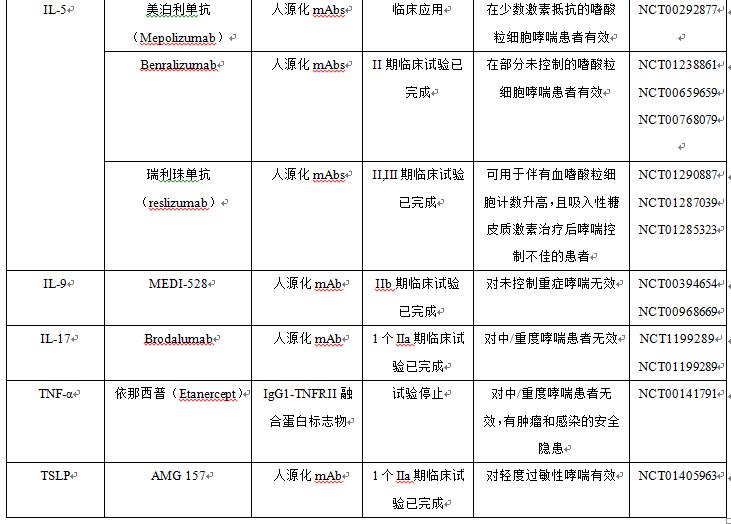
注:TNF—a为肿瘤坏死因子a;TSLP为胸腺基质淋巴细胞生成素
4.哮喘的遗传药理学

注:TNF—a为肿瘤坏死因子a;TSLP为胸腺基质淋巴细胞生成素
个体化治疗的目标是增强疗效并减少不良反应。药物治疗个体变异性的影响因素包括年龄、性别、种族、与其他药物的相互作用和肝肾功能等。目前研究的重点是针对3个主要的哮喘治疗药物,包括ICS、β2受体激动剂和白三烯调节剂。证据表明,治疗哮喘疗效存在个体性差异的主要原因之一,即为遗传因素。遗传药理学研究遗传因素对药物代谢动力学的影响,可根据不同的基因编码决定药理学疗效。通过遗传药理学方法,测定候选基因、基因多态性是重要的手段[19]。
4.1 β2受体激动剂 β2受体定位于染色体5q31-32。常见的β2受体单核苷酸基因多态性(SNP)就是16位的精氨酸(Arg)被甘氨酸(Gly)代替(Arg16Gly)。研究证实Gly16受体亚型可耐受比Arg16更多的激动剂诱导的受体下调;另一个常见的β2受体SNP是谷氨酸(Glu)27亚型,即谷氨酸27谷氨酰胺(Glu27Gln),可显著减少细胞系中激动剂促使的下调[20]。另外,对携带Glu27表型的人肺肥大细胞的研究,亦证实了其对激动剂诱导的钝化作用具有一定的抵抗力[21]。SNP研究还发现,苏氨酸164异亮氨酸(Thr164Ile)中,Ile164亚型可削弱激动剂的结合,并促进受体钝化[22]。哮喘患者体内β2受体SNP对β2受体激动剂的反应,迄今仍未完全清楚。早期研究显示,与Gly16纯合子比较,Arg16纯合子对沙丁胺醇具有更好的应答[23]。也有研究发现,Gly16纯合子的哮喘患者,对福莫特罗的作用则呈现明显的支气管舒张剂钝化现象[24];而另外研究并未发现上述现象[25]。2007年对2652例哮喘患者的研究也发现,给予沙美特罗或福莫特罗治疗后,β2受体激动剂亚型与临床结果无相关性[26]。一项随机、安慰剂对照的交叉试验也发现,对Arg16纯合子(n=42)和Glyl6纯合子(n=45)的哮喘患者给予沙美特罗治疗,其临床结果无差异[27]。
4.2激素 数十年前即发现了哮喘患者存在激素抵抗型的现象。哮喘患者存在激素受体(GCCR/NR3C1)基因的突变,曾作为该现象的生物学解释。研究也发现,家族性的激素抵抗,是由于GCCR基因的氨基酸取代所致;然而在其他的激素抵抗型哮喘的研究中,未发现存在相同的突变[28]。3个哮喘队列的候选基因研究鉴别了促肾上腺皮质激素释放激素受体1(CRHR1)基因的SNP,结果发现CRHR1基因的SNP与ICS疗效相关[29]。对编码转录因子T-bet的TBX21基因的研究发现,氨基酸取代与ICS治疗后的气道高反应性(AHR)相关[30]。相同的SNP与激素治疗后的哮喘控制相关,但其结果并不符合先前的研究[31]。压力诱导的磷蛋白1(STIP1)基因,也作为激素应答的候选基因列入研究,并发现其SNP与糖皮质激素应答相关,但潜在的机制尚未明确[32]。
4.3 白三烯调节剂 3个常见的白三烯调节剂包括齐留通(5-脂氧合酶抑制剂)、扎鲁司特和孟鲁司特(白三烯受体拮抗剂)。有研究比较了选择性5-脂氧合酶抑制剂(ABT-761)与5-脂氧合酶基因启动子SNP的相关性,结果发现,低于正常启动子拷贝数的患者亚群(5%)中,其5-脂氧合酶表达减少,并对ABT-761的应答较弱[33]。近来关于5-脂氧合酶基因SNP的研究发现,其可影响对白三烯调节剂的治疗反应[34]。白三烯C4合酶基因SNP的研究显示,其可影响重症哮喘患者口服扎鲁司特的临床疗效[35]。
4.4 全基因组相关研究 近年来全基因组关联研究的开展,加深了对哮喘易感性的认识。目前已有6个基因组区域被鉴别出,分别是ORMDL3-GSDMB区域[36]、IL33[36]、IL1RL1-IL18R1区域[36]、RAD50-IL13区域[37]、TSLP-WDR36区域[36,38]和HLA-DR/DQ区域[36,38]。然而,哮喘的遗传药理学研究刚刚起步,其结论尚未一致。
5.哮喘的生物学标记
生物学标记,即一个具有客观测定和评估正常生理学进程、致病性进程或者药物治疗干预应答的指示器。在临床终点相对或绝对缺少时,可将特异性生物学标记作为临床终点的替代物。结合多个生物标记,可通过个体化的病理学体征,进一步精确疾病的亚表型,并为临床提供更好的药物类型和剂量。
5.1 活组织标本 迄今为止,评估气道炎症和气道重塑最精确的方法就是肺组织活检,可通过特殊染色鉴定肺组织切片中炎症细胞的亚型。但肺组织活检需要通过支气管镜检查,具有侵袭性,也需要有经验的病理学专家进行组织检查。
5.2 诱导痰 诱导痰检查可作为评估气道炎症的替代方法。现认为炎症细胞可浸润至气道管腔,痰液中的炎性细胞与组织中的相符合。测定诱导痰中的嗜酸粒细胞和中性粒细胞有助于鉴别哮喘亚群,如中性粒细胞性哮喘和嗜酸粒细胞性哮喘,并可评估激素的治疗反应[12]。尽管诱导痰检查较准确,但临床费时,也需要一定的技术。由于患者的配合程度等,有时结果难以复制。
5.3 呼出气一氧化氮(FeNO) 目前为止,FeNO是最广泛使用的,反映哮喘气道炎症的呼出生物标记物。尽管测试费用较高,但FeN0可在临床快速检测[39]。
现认为FeNO是嗜酸粒细胞性炎症的生物学标记,当患者存在高水平的FeNO时应给予糖皮质激素治疗;FeNO的测定有助于合理选择哮喘的治疗方案以及预测哮喘急性加重[40]。研究发现,当哮喘控制不佳和/或哮喘急性加重时,FeNO水平明显升高[40-41]。van Veen等[42]发现,FeNO可作为难治性哮喘患者肺功能快速下降的预测因子。de Jongste等[43]发现FeNO可用于评估息者治疗的依从性。综上,FeNO将有助于临床医师判断哮喘患者的控制程度和未来风险,同时有助于减少哮喘急性加重和选择最佳治疗方案。
ATS建议将FeNO成人水平分为<25 ppb、25~50 ppb以及>50 ppb 3组,儿童为<20 ppb、20~35 ppb以及>35 ppb 3组[44]。其中成人<25 ppb,儿童<20 ppb,可初步排除嗜酸粒细胞性炎症。不建议给予激素治疗(强烈推荐,证据质量中度);成人>50 ppb,儿童>35 ppb,提示嗜酸粒细胞性炎症可能,并建议有症状者应该给予激素治疗(强烈推荐,证据质量中度);成人25~50 ppb,儿童20~35 ppb,应警惕并行进一步临床评估(强烈推荐,证据质量低度)。另外,成人25~50 ppb时,考虑存在轻度的嗜酸粒细胞性炎症,此时应关注患者的临床症状、体征以及其他相关实验室参数;而成人>50 ppb时,也提示有过敏原暴露的风险[45]。
由于在成人[46]、儿童[47]以及老年[48]哮喘患者中的结论不一致,因此,目前不推荐单独应用FeNO测定来直接诊断哮喘,而必须与其他诊断方法相联合。Vijverberg等[49]也表述了同样的观点。
5.4 呼出气温度(EBT) 有研究发现,哮喘时存在单个EBT峰值增高,原因可能是哮喘性气道炎症或者哮喘伴随症状导致支气管血流增多,并可致使经气道散热增加,而出现EBT增高[50]。也有研究发现哮喘时单个EBT峰值不增高,而出现EBT峰值持续时间增加,并与支气管血流和气道炎症呈正相关[51-52]。而抗炎治疗后,则出现单个EBT峰值和EBT峰值持续时间的减少[51] 。提示EBT可作为评估哮喘控制的有效的生物学标记物。但目前EBT的研究仍较少。
5.5 呼出气冷凝物(EBC) 研究发现,与正常人比较,嗜酸性细胞性哮喘患者EBC的pH值明显降低;哮喘病情越重者,其EBC的pH值降低的越明显[53]。而在异氰酸盐类诱导的职业性哮喘患者中,未发现EBC的pH值降低[54]。一些研究也发现,一氧化氮(NO)产物[55]、谷胱甘肽和醛类[56]、过氧化氢(H2O2)[57]、细胞因子(IL-4、IL-5、IL-4/IFN-γ)[58]可作为评估哮喘病情严重程度和/或治疗反应的生物标记物。
5.6 血清蛋白类 尽管哮喘是一种气道性疾病,但有证据证实哮喘亦会导致全身性改变,并可在血循环中存在特异性代谢产物。一些血清生物学标记与哮喘相关,包括嗜酸粒细胞阳离子蛋白(ECP)。过敏原激发后出现ECP增加,而脱离过敏原以及应用糖皮质激素治疗,则出现ECP下降。临床研究发现,血清ECP水平升高,可作为哮喘的特异性标记物,但并不能反映慢性哮喘治疗后导致的功能变化,也不能预测激素的治疗反应[59]。肥胖作为一个重要的环境因素,与哮喘相关。瘦素/脂联素平衡与肥胖的发生相关,而在肥胖或非肥胖的哮喘患者中存在瘦素和脂联素水平的变化[60]。另外有研究发现,哮喘患者的痰液和血清中,趋化因子CCL-17明显升高,而CCL-17可募集Th2细胞进入肺内[61-62]。哮喘患者的痰液和血清中壳多糖酶样蛋白YKL-40水平也同样出现升高,并与哮喘严重性相关丛[63]。近来研究发现,血清骨膜蛋白可作为Th2激活的生物学标记,并与气道炎症相关[64]。
5.7 尿中代谢产物 组胺的代谢产物,N-甲基组胺在哮喘患者尿液中比例增加,并在过敏原激发和急性加重时迸一步增高[65]。
6.总结与展望
哮喘是一种复杂的综合征,伴有多种潜在性的病理学改变,因此在疾病触发、进展和治疗反应上存在明显的个体差异性,即存在异质性。哮喘的临床管理要求采取个体化治疗方案,而GINA的阶梯式治疗方案不能完全体现个体化治疗。目前的糖皮质激素等治疗,并非对所有哮喘患者有效,还存在相当多的不良反应。新颖的抗哮喘药物的设计原理是干预特异性细胞信号通道,但哮喘的异质性使得这些新药仅对某些哮喘亚型有效。遗传药理学和全基因组关联研究对预测个体治疗反应有效,但还需要更好的表型以及更大的样本量来证实。肺功能测试不能鉴定哮喘鹘表型和内型,生物学标记,尤其是非侵袭性生物学标记有助于哮喘亚型的鉴定,并有助于评估治疗反应。
参考文献
1. Beasley R. The burden of asthma with specific reference to the United States[J],J Allergy Clin Immunol,2002, 109(5Suppl): S482-$489. DOI: 10. 1067/mai. 2002. 122716.
2. Moore WC. Meyers DA, Wenzel SE, et al. Identification of asthma phenotypes using cluster analysis in the Severe Asthma Research Program[J]. Am J Respir Orit Care Med, 2010. 181(4): 315-323. DOI: 10. 1164/teem. 200906-08960C.
3. Siroux V, Basagafia X. Boudier A, et al. Identifying adult asthma phenotypes using a clustering approach[J]. Eur Respir j, 201I, 38(2): 310-317, DOI: 10. Z183/09031936.00120810.
4. Global Strategy for Asthma Management and Prevention (2015 update). Global Initiative for Asthma(GINA)[EB/ OL]. Available at: 2015. http: //www. ginasthma org.
5. Anderson GP. Endotyping asthma: new insights into key pathogenic mechanisms in a complex, heterogeneous disease [J]. Lancet, 2008, 37Z(9643): 1107-1119. DOI: 10. 1016/S0140-6736(08)61452-X.
6. o’brien CE, Tsirilakis K, Santiago MT. et al. Heterogeneity of lower airway inflammation in children with severe-persistent asthma£玎, Pediatr Pulmono_l, 2015, 50(t2): 1200-1204. DOI: 10. 1002/ppul. 23165.
7. Schleich F, Brusselle G, Louis R, et al. Heterogeneity of phenotypes in severe asthmatics. The Belgian Severe Asthma Registry(BSAR)[J]. Respir Med, 2014. t08(12): 1723-1732. DOI: 10. 1016/i. rmed. 2014. 10. 007.
8. Sorkness CA, Lemanske RF. Mauger DT, et al. Long-term comparison of 3 controller regimens for mild-moderate persistent childhood asthma: the Pediatric Asthma Controller TrialD]. J Allergy Clin Immunol, 2007, 119(1): 64-72. DOI: 10.1016/j. jaci. 2006. 09. 042.
9. Green RH, Brighding CE. Wohmann G, et al, Analysis of induced sputum in adults with asthma: identification of subgroup with isolated sputum neutrophilia and poor response to inhaled corticosteroids[J]. Thorax, 2002, 57(10): 875-879. DOI: 10. 1136/thorax, 57, 10. 875.
10. Malmstr6m K, Pelkonen AS. Malmberg LP, et al. Lung function, airway remodelling and inflammation in symptomatic imams: outcome at 3 years[J]. Thorax, 201 1. 66 (2): 157-162. DOI: 10. 1136/thx, 2010. 139246,
11. Holgate ST. Pathophysiology of asthma: what has our current understanding taught us about new therapeutic approaches? [J]. J Allergy Clin Immunol.2011, 128(3): 495-505. DOI: 10. 1016/j. jaci. 2011 06. 052.
12. Wenzel S, Ford L, Pearlman D, et al. Dupilumab in persistent asthma with elevated eosinophil levels[J]. N Engl J Med. 2013. 368(26): 2455-2466. DOI: 10, 1056/NEJMoal304048.
13. Corren J, Lemanske RF, Hanania NA, et at. Lebrikizumab treatment in adults with asthma[J]. N Engl J Med, 201 1, 365 (12): 1088-1098. DOI: 10. 1056/NEJMoall06469.
14. Hanania NA, Noonan M, Corren J, et al. Lebrikizumab in moderate-to-severe asthma: pooled data from two randomized placebo-controlled studies[J]. Thorax, 2015, 70(8): 748-756. DOI: 10. 1136/thoraxjnl-2014-206719.
15. Oh CK, Leigh R, McLaurin KK, et al. A randomized, controlled trial to evaluate the effect of an anti-interleukin-9 monoclonal antibody in adults with uncontrolled asthma[J]. Respir Res, 2013. 14: 93. DOI: 10. 1186/1465-9921-14-93.
16. Busse WW, Holgate S. Kerwin E, et al. Randomi2ed, Double Blind, placebo-controlled study of brodalumab, a human Anti-IL-l7 receptor monoclonal antibody. in moderate to severe asthma[J]. Am J Respir crit care Med, 2013, 188(11): 1294-1302. DOI: 10. 1164/rccm. 201212-23180C.
17. Gauvreau GM, O’byrne PM, Boulet LP, et al, Effects of an anti-TSLP antibody on allergen-induced asthmatic responses[J]. N Engl J Med, 2014, 370(22): 2102-2110. DOI: 10. 1056/NEJMoal402895.
18. Fajt ML. Wenzel SE. Asthma phenotypes and the use of biologic medications in asthma and al1ergic disease: the next steps toward personall2ed care[J], J ALlergy Clin Immunol, 2015, 135(2): 299-3l0;quiz 31l, DOI: l0. 1016/j. jaci. 2014. 12. 1871.
19. Manolio TA. Genome wide association studies and assessment of the risk of disease口]. N En91 J Med, 2010, 363(2): 166-176, DOI: 10. 1056/NEjMoa0905980.
20. Green SA, Turki J, Bejarano P, et al. Influence of beta 2-adrenergic receptor genotypes on signal transduction in human airway smooth muscle ceIls[r]. Am J Respir cell Mol Biol, 1995, 13(1): 25-33. DOI: 10. 1165/ajrcmb. 13. 1. 7598936.
21. Chong LK, chowdry J, Ghahramani P, et al. Influence of genetic polymorphisms in the beta2-adrenoceptor on desensitization in human lung mast cells [J]. Pharmacogenetics, 2000, 10(2): 153-162.
22. Rathz DA. Gregory KN, Fang Y. et al. Hierarchy of polymorphic variation and desensitization permutations relative to beta 1-and beta 2-adrenergic receptor signaling [J]. J Bio1 Chem, 2003, 278(12): 10784-10789. DOI: 10. 1074/jbc. M206054200.
23. LimajJ, MDhamed MH. SelfTH, et al. Importance of beta(2) adrenergic receptor genotype, gender and race on albuterol-evoked bronchodilation in asthmatics[J]. Pulm Pharmacol Ther, 2000. 13(3): 127-134. DOI: 10. 1006/pupt, 2000. 0239.
24. Tan S, Hall IP, Dewar J, et al. Association between beta 2-adrenoceptor polymorphism and susceptibility to bronchodilator desensitization in moderate severe stable asthmatics[J]. Lancet, 1997, 350(9083): 995-999. DOI: 10. 1016/S0140-6736(97)0321l-X.
25. Lipworth IV, Dempsey OJ, Aziz I. Functional antagonism with formoteroI and salmeterol in asthmatic Patients expressing the homozygous glycine-16 beta(2)-adrenoceptor polymorphism[J]. chest, 2000, 118(2): 321-328. DOI: 10. 1378/chest. 118. 2. 321.
26. BIeecker ER. Postma DS. Lawrance RM. et aI. Effect of ADRBZ polymorphisms on response to long acting beta2- agonist therapy: a pharmacogenetic analysis of two randomized studies[J]. Lancet, 2007. 370(965): 2118-2125. DOI: 10. 1016/S0140-6736(07)61906-O
27. wechsler ME, Kunselman sJ, Chinchilli VM, et aI. Effect of beta2-adrenergic receptor polymorphism on response to longacting beta2 agonist in asthma (LARGE trail): a genotype-stratified, randomised, placebo-controlled, crossover trial[J]. Lancet, 2009, 374(973): 1754-1764. DOI: 10. 1016/S0140-6736(09)61492-6.
28. Lane SJ, Arm JP, Staynov DZ, et al, chemical mutational analysis of the human glucocorticoid receptor cDNA in glucocorticoid-resistant bronchial asthma[J]. Am J Respir Cell Mol Bio1. 1994. 11(1): 42-48. DOI: 10. 1165/ajrcmb. 11. 1. 8018337.
29. Tantisira KG, Lake S, Silverman ES. et al. Corticosteroid pharmacogenetics: association of sequence variants in CRHRl with improved lung function in asthmatics treated with inhaled corticosteroids[J], Hum Mol Genet, 2004, 13(13): 1353-1359. DOI: 10. 1093/hmg/ddhl49.
30.Tantisira KG, Hwang Es, Raby BA, et al. TBX21: a functional variant predicts improvement in asthma with the use of inhaled corticosteroids[J]. Proc Natl Acad Sci USA, 2004, 101(52): 18099-18104. DOI: 10. 1073/pnas. 0408532102.
31. Ye YM, Lee HY. Kim SH, et al. Pharmacogenetic study of the effects of NK2R G231E G>A and TBX21 H33Q C>G polymorphisms on asthma control with inhaled corticosteroid treatment[J], J clin Pharm Ther, 2009. 34(6): 693-701. DOI: 10. 1111/j. 1365-2710, Z009. 01054. x.
32. Hawkins GA, Lazarus R, Smith RS, et al-The glucocorticoid receptor heterocomplex gene ST1Pl is associated with improved lung function in asthmatic subjects treated with inhaled corticosteroids[I]. J Allergy Clin Immunol, 2009, 123(6): 1376-83. e7. DOI: 10. 1016/j. jaci. 2009. 01. 049.
33. Drazen JM, Yandava CN, Dube L, et al. Pharmacogenetic association between ALOX5 promoter genotype and the response to anti. asthma treatment[J]. Nat Genet. 1999, 22 (2): 168-170. DOI: 10. 1038/9680.
34. Klotsman M, York TP, Pillai SG, et al, Pharmacogenetics of the 5-lipoxygenase biosynthetic pathway and variable clinical response to montelukast[J]. Pharmacogenet Genomics, 2007, 17(3): 189-196. DOI: 10. 1097/FPC. 0b013e3280120043,
35. Sampson AP, Siddiqui S, Buchanan D, et al. Variant LTC(4) synthase allele modifies cysteinyl leuk. triene synthesis in eosinophils and predicts clinical response to zafirlukast[J]. Thorax, 2000, 55(Suppl 2): S28-S31. DOI: 10. 1136/thorax. 55. suppl2, Sz8.
36. Moffatt MF. Gut IG, Demenais F, et al. A 1arge-scale, consortium-based genomewide association study of asthma [J]. N Engl J Med, 2010, 363(13): 1211-1221. DOI: 10, 1056/NEJMoa0906312.
37. Li x, Howard TD, Zheng SL, et al. Genome-wide association study of asthma identifies RAD50-ILl 3 and HLA-DR/DQ regions[J]. J AIIergy Clin Immunol, 2010, 125(2): 328-335. e11. DOI: 10. 1016/j. jaci. 2009. 11. 018.
38. Hirota T, Takahashi A, Kubo M, et al. Genome-wide association study identifies three new susceptibility loci for adult asthma in the Japanese population[J]. Nat Genet, 2011. 43(9): 893-896. DOI: 10. 1038/ng. 887.
39. Reddel HK, Taylor DR, Bateman ED, et al. An official American Thoracic Society/European Respiratory Society statement: asthma control and exacerbations: standardizing endpoints for clinical asthma trials and clinical practice[J]. Am J Respir Crit Care Med, 2009, 180(1): 59-99. DOI: 10. 1164/rccm. 200801-060ST.
40. Berry MA, Shaw DE, Green RH, et al. The use of exhaled nitric oxide concentration to identify eosinophilic airway inflammation: an observational study in adults with asthma [J]. Clin Exp Allergy, 2005, 35(9): 1175-1179. DOI: 10. 1111/j. 1365-2222. 2005. 02314. x.
41. Gelb AF, Flynn Taylor C, Shinar CM, et al. Role of spirometry and exhaled nitric oxide to predict exacerbations in treated asthmatics口]. Chest, 2006, 129(6): 1492-1499. DOI: 10. 1378/chest. 129. 6. 1492.
42. van Veen IH, Ten Brinke A, Sterk PJ, et al. Exhaled nitric oxide predicts lung function decline in difficult-to-treat asthma[J]. Eur Respir J, 2008, 32(2): 344-349. DOI: 10. 1183/09031936. 00135907.
43. de Jongste JC, Carraro S, Hop WC, et al. Daily telemonitoring of exhaled nitric oxide and symptoms in the treatment of childhood asthma[J1. Am J Respir Crit Care Med, 2009, 179(2): 93-97. DOI: 10. 1164/rccm. 200807-10100C.
44. Dweik RA, Boggs PB, Erzurum SC, et al. An officiaI ATS clinical practice guideline: interpretation of exhaled nitric oxide levels(FENO)forclinical applications[J]. Am J Respir Crit Care Med, 2011, 184(5): 602-615. DOI: 10. 1164/recto. 9120-l lST.
45. Spitale N, Popat N, Mcivor A. Update on exhaled nitric oxide in pulmonary disease[J]. Expert Rev Respir Med, 2012, 6(1): 105-115. DOI: 10. 1586/ers. 12. 1.
46. Feitosa LA, Dornelas De Andrade A, Reinaux CM, et al. Diagnostic accuracy of exhaled nitric oxide in exercise-induced bronchospasm: Systematic review[J]. Rev Port Pneumol, 2012, 18(4): 198-204. DOI: 10. 1016/j. rppneu. 2012. 01. 008.
47. Mahr TA, Malka J, Spahn JD. Inflammometry in pediatric asthma: a review of fractional exhaled nitric oxide in clinical practice [J]. Allergy Asthma Proc, 2013, 34(3): 210-219. DOI: 10. 2500/aap. 2013. 34. 3660.
48. Columbo M, Wong B. Panettieri RA, et al. Asthma in the elderly: the role of exhaled nitric oxide measurements[J]. Respir Med. 2013, 107(5): 785-787. DOI: 10. 1016/j. rmed. 2013. 01. 018.
49. Vijverberg SJ, Hilvering B, Raaijmakers JA, et al. Clinical utility of asthma biomarkers: from bench to bedside[J]. Biologics, 2013, 7: 199-210. DOI: 10. 2147/BTT. S29976.
50. Popov TA. Dunev S, Kralimarkova TZ, et al. Evaluation of a simple, potentially individual device for exhaled breath temperature measurement[J]. Respir Med, 2007, 101(10): 2044-2050. DOI: 10. 1016/j. rmed. 2007. 06. 005.
51. Paredi P, Kharitonov SA, Barnes PJ. Faster rise of exhaled breath temperature in asthma: a novel marker of airway inflammation?[J], Am J Respir Crit Care Med, 2002, 165(2): 181-184. DOI: 10. 1164/ajrccm. 165. 2. 2103053.
52. Paredi P, Kharitonov SA, Barnes PJ. Correlation of exhaled breath temperature with bronchial blood flow in asthma[J]. Respir Res, 2005. 6: 15. DOI: 10. 1186/1465-9921-6-15.
53. Vlasic Z, Dodig S, Cepelak 1. et al. Iron and ferritin concentrations in exhaled breath condensate of children with asthma[J]. J Asthma, 2009, 46(1): 8l-85. DOI: 10. 1080/02770900802513007.
54. Ferrazzoni S, Scarpa MC, Guarnieri G. et al. Exhaled nitric oxide and breath condensate ph in asthmatic reactions induced by isocyanates[J]. Chest, 2009, 136(1): 155-162. DOI: 10. 1378/chest. 08-2338.
55. Morton J, Henry RL, Thomas PS. Exhaled breath condensate nitrite/nitrate and pH in relation to pediatric asthma control and exhaled nitric oxide[J]. Pediatr Pulmonol, 2006, 41(10): 929-936. DOI: 10. 1002/ppul. 20469.
56. Dut R, Dizdar EA, Birben E, et al. Oxidative stress and its determinants in the airways of children with asthma[J]. Allergy, 2008. 63(12): 1605-1609. DOl: 10. 1111/j. 1398-9995. 2008. 01766. x.
57. Teng Y, Sun P, Zhang J, et al. Hydrogen peroxide in exhaled breath condensate in patients with asthma: a promising biomarker?[J]. Chest, 2011, 140(1): 108-116. DOI: 10. 1378/chest. 10-2816.
58. Shahid SK. Kharitonov SA, Wilson NM, et al. Increased interleukin-4 and decreased interferon-gamma in exhaled breath condensate of children with asthma [J]. Am J Respir Crit Care Med, 2002, 165(9): 1290-1293. DOI: 10.1164/rccm. 2108082.
59. Lessard A, Turcotte H, Cormier Y, et al. Obesity and asthma: a specific phenotype?[J]. Chest, 2008, 134(2): 317-323. DOI: 10. 1378/chest. 07-2959.
60. Lessard A, St-Laurent J, Turcotte H, et al. Leptin and adiponectin in obese and non-obese subjects with asthma[J]. Biomarkers, 2011, 16(3): 271-273. DOI: 10. 3109/1354750X. 2010. 550013.
61. Sekiya T, Yamada H, Yamaguchi M, et al. Increased levels of a TH2-type CC chemokine thymus and activation-regulated chemokine(TARC) in serum and induced sputum of asthmatics[J]. Allergy, 2002, 57(2): 173-177. DOI: 10. 1034/j. 1398-9995. 2002. 1s3256. x.
62. Leung TF, Wong CK, Chan IH, et al. Plasma concentration of thymus and activation-regulated chemokine is elevated in childhood asthma[J]. J Allergy Clin Immunol, 2002, 110(3): 404-409. DOI: 10. 1067/mai. 2002. 126378.
63. HartI D. Lee CG, Da Silva CA, et al. NoveI biomarkers in asthma: chemokines and chitinase-like proteins[J]. Curr Opin Allergy Clin Immunol, 2009, 9(1): 60-66. DOI: 10. 1097/ACI. 0b013e32831f8ee0.
64. Li W, Gao P, Zhi Y, et al. Periostin: its role in asthma and its potential as a diagnostic or therapeutic target[J]. Respir Res, 2015. 16: 57. DOI: 10. 1186/s12931-015-0218-2.
65. Takei S, Shimago A, Iwashita M, et al. Urinary N-methylhistamine in asthmatic children receiving azelastine hydrochloride[J]. Ann Allergy Asthma Immunol, 1997, 78(5): 492-496. DOI: 10. 1016/S1081-1206(10)63237-1.
上一篇:
没有了
下一篇:
没有了









